Veröffentlicht 4. Juli 2011 von Beatrice Lugger
Ein Mann, der Gott spielt? – Ham Smith über synthetische Biologie
Vor gut einem Jahr ging ein Aufschrei durch die Medienwelt. ‚Ein Mann spielt Gott‚, wurde etwa geschrieben. Der Mann, auf den alle anspielten, ist Craig Venter. In seinen Laboren entstand erstmals sozusagen Leben vom Reißbrett: Das meinte eine DNA aus dem Labor, wurde in eine leere Zellhülle geschoben. Dies wurde als erste ‚synthetische Zelle’ gefeiert und ethisch hinterfragt. Der Mann, der bei Craig Venter die entsprechende Abteilung seiner Labore zur synthetischen Biologie in La Jolla und Rockville leitet und tatsächlich im Labor steht, ist Hamilton O. Smith. Smith war 1978 gemeinsam mit Werner Arber und Daniel Nathans für die Entdeckung und Anwendung von Restriktionsenzymen mit dem Medizinnobelpreis ausgezeichnet worden.
Smith begleitet Venter bereits seit 1993 und war maßgeblich an der Entschlüsselung des menschlichen Genoms bei Venters Firma Celera Genomics beteiligt. In jüngster Zeit widmet er sich den Grundbausteinen des Lebens auf andere Weise. Mir fiele kein anderer Genomforscher ein, der wie Ham Smith über Jahrzehnte eine vergleichbar zentrale Rolle in der Genetik einnimmt. Er verbringt noch immer die Hälfte seiner Zeit im Labor, wie er sagt, und wäre „sehr gerne wieder Post-Doc“.
v.l. Beatrice Lugger, Hamilton O. Smith, Lucas Brouwers (picture: Christine Ottery)
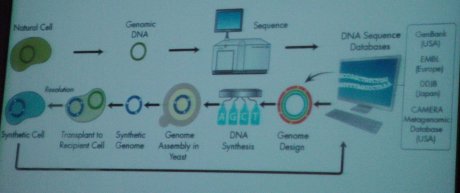
Von dem berühmten Physiker Richard Feynman stammt der Satz „Was ich nicht erschaffen kann, verstehe ich nicht.“ Im vergangenen Jahr hatte Hamilton O. Smith gemeinsam mit Venter ein Bakterium (Mycoplamsa mycoides) präsentiert, dessen DNA komplett synthetisch hergestellt und in einer ausgeschlachteten Zellhülle hochgefahren worden war. Ham Smith spricht in diesem Zusammenhang gerne von der DNA als Software und der Zellhülle als der Hardware. Am J. Craig Venter Institute (JCVI) bauen sie also ‚nur’ die Software neu auf.
Hier der Abstract des Papers (1): We report the design, synthesis and assembly of the 1,08-mega-base-pair Mycoplasma mycoides JCVI-syn1.0 genome starting from digitized genome sequence information and its transplantation into a M. capricolum recipient cell to create new M. mycoides cells that are controlled only by the synthetic chromosome. The only DNA in the cells is designed synthetic DNA sequence, including “watermark” sequences and other designed gene deletions and polymorphisms, and mutations acquired during the building process. The new cells have expected phenotypic properties and are capable of continuous self-replication.
Dafür hatten sich die Forscher zuerst der Knock-out-Methode bedient, um festzustellen, welche Gene dieses einfache Bakterium zum Überleben unter Laborbedingungen benötigt, und nur diese schließlich nachgebaut und eingesetzt. Die Idee, die Smith und Venter mit solchen reduzierten Organismen verknüpfen, sind mittelfristig Laborbakterien, die biotechnologische Aufgaben, wie etwa die Produktion von Brennstoff, übernehmen. Smith glaubt, „dass es in Zukunft möglich sein wird, Zellen zu konstruieren, die von synthetischem Genom gesteuert werden und die dank ihres Designs diverse nützliche Produkte herstellen können.“
Aus dem Vortrag von Hamilton O. Smith
Lucas Brouwers und ich konnten mit einem entspannten und sympathischen Ham Smith am Rande der Lindauer Nobelpreisträgertagung über seine Forschung und Visionen reden. Ich habe einen ersten Teil unseres Gesprächs zusammengestellt. Ein zweiter Teil wird folgen.
Ihr Hauptinteresse gilt heute dem Verständnis der zentralen Basiseinheiten einer Zelle. Was fasziniert Sie daran?
Smith: Ich will versuchen zu verstehen, wie eine Zelle arbeitet. Denn ich glaube, wir verstehen noch nicht einmal die einfachsten Zellen. Von Viren wissen wir dagegen bereits vergleichbar viel, denn sie haben nur wenige Gene. Nehmen wir beispielsweise den Lambda-Phagen (Anm.: Virus aus der Gruppe der Bakteriophagen, dessen Wirt das Bakterium Escherichia coli ist). Über 50 Wissenschaftler haben diesen genauestens untersucht. Aber Zellen, selbst einfachste Bakterienzellen, haben eine Menge an Genen, von denen wir nicht wissen, wozu sie gut sind. Deshalb richtet sich unser Interesse auf die Minimalzelle. Wir können die Zelle von Genen befreien, die sie offensichtlich nicht zum Überleben benötigt, sodass am Ende nur noch die fundamentale Basiszelle mit allem, das wirklich zum Überleben benötigt wird, übrig bleibt. Und dann können wir untersuchen, was jedes einzelne Gen in der Zelle macht. Das ist Grundlagenforschung!
Wie muss man sich das genau vorstellen?
Smith: Indem wir einzelne Gene ausschalten, erwarten wir, etwas über ihre Funktion zu erfahren. Das kann beispielsweise bedeuten, dass die Zelle nicht mehr wächst oder langsamer. Dann wissen wir, dieses Gen ist lebensnotwendig und setzen es wieder ein und entfernen dafür ein anderes Gen. Wir gehen hier konsequent von einem Startpunkt bis zu dem Punkt, ab dem man nichts mehr entfernen kann. Es kann durchaus sein, dass es mehrere verschiedene Wege bis zu einem solchen Punkt gibt. Es kann also sein, dass es nicht das eine Endprodukt gibt. Es könnte eine Menge verschiedener Zellen mit Minimalgenom geben (Anm. je nach Ausgangspunkt). So wird zwar eine bestimmte Funktion benötigt, aber diese kann durch dreierlei Proteine erfüllt werden. Man könnte also eines der drei entfernen und die Zelle würde trotzdem überleben. Nur wenn wir alle drei entfernen, wird sie wahrscheinlich sterben. Ein Pfad könnte also zur Entfernung von A und B, ein anderer zur Entfernung von B und C und so weiter führen.
Wie steht es mit der von Ihnen hergestellten ‘synthetischen Zelle’ – haben Sie dort bereits alle Funktionen verstanden?
Smith: Nein. Was wir gemacht haben, ist eine nur leicht modifizierte Kopie einer existierenden Zelle. Die Hauptarbeit liegt jetzt darin, diese noch von nicht-essenziellen Genen zu befreien. Mycoides, also die Zelle, von der wir eine synthetische Kopie erstellten, zählt mehr als 900 Gene. Durch extensive Knock-Outs der Gene wissen wir, dass ungefähr 600 davon nicht lebenswichtig sind. Also beginnen wir nun, diese wegzuwerfen. Es ist so wie bei einem Auto, dessen Motor eine Menge an Extras hat, die nicht wichtig ist, damit das Auto fahren kann. Man könnte dies alles weglassen.
Sie beschreiben das Genom als die Software und den Rest der Zelle als Hardware. Sie bauen nun ‘nur’ die Software synthetisch nach. Braucht man nicht beides, weil diese interagieren?
Smith: Das ist das Henne-Ei-Problem. Natürlich kann die Software nicht ohne Hardware und umgekehrt. Die DNA ist das operative System der Zelle. Wir sprechen hier über Bakterien, nicht über komplexe Zellen. Bei Eukaryoten gibt es noch eine Menge epigenetischer Faktoren, die man berücksichtigen müsste, aber bei Bakterien haben wir dieses Problem nicht. Bisher zumindest. Wenn man also ein funktionierendes Genom bauen kann, und dies in einem Zytoplasma – auch einer fremden Spezies – booten kann, dann wird die DNA zur Bildung der ihrer Software entsprechenden Proteine führen. Mit den Zellteilungen gehen die Proteine des Zytoplasmas nach und nach verloren. Ungefähr nach 20 Zellteilungen finden wir in den Zellen nur noch Proteine, die durch Ablesen des synthetischen Genoms gebildet werden.
Dieses erste synthetische Genom war eine Kopie. Aber sie wollen wohl selbst eines bauen.
Smith: Designen meinen Sie! Auf lange Sicht wollen wir das wirklich. Sobald wir die notwendigen Grundbausteine kennen, sollten wir fähig sein, mittels eines Computerprogramms die Ingredienzien eines Genoms zusammenzustellen und verschiedene Arrangements durchzuspielen und so weiter. Wir wissen nicht, wie anfällig die Arrangements sind. Manche Leute fragen, was wir mit einer solchen Zelle machen werden, wenn wir sie mal haben. Vielleicht nichts! (Ham Smith lacht!) Es wird eine sehr anfällige, langsam wachsende Zelle, die sich nur im Labor wohl genug fühlt, um überhaupt zu wachsen.
Wie sehr beschäftigen Sie ethische Fragen rund um die synthetische Biologie?
Smith: Nicht sehr viel. Es ist vergleichbar mit der Zeit, als wir begannen, DNA mit Hilfe der Restriktionsenzyme zu rekombinieren. Wir zerschnitten DNA in Teile und fingen an, diese hin- und herzuschieben. Wir dachten, wir würden damit Grenzen der Natur überschreiten. Nach einiger Zeit bemerkten wir, dass die Natur all dies selbst macht und die Bedenken gegenüber der rekombinanten DNA sind mehr oder weniger verschwunden.
Jetzt wiederbelebe ich dieses Feld mit einer viel nachhaltigeren Methode. Jetzt können wir DNAs kreieren, die bislang nicht existieren. Oder wir können Veränderungen vornehmen, die mit herkömmlichen Methoden der Genetik nicht machbar sind. Die Methode mag wirksamer sein, aber wir wissen eigentlich nicht genug, um etwas wirklich Gefährliches herstellen zu können. Was wir machen, ist vielmehr schwächer und spezialisierter. Deshalb mache ich mir da keine Sorgen. Aber wir sollten darüber nachdenken und diskutieren, weil die Öffentlichkeit sich über diese Dinge sorgt.
Wir haben eine exakte Kopie eines Ziegenpathogens hergestellt. Dabei arbeiten wir mit einem schwachen Stamm, der nicht wirklich gefährlich ist, der aber Ziegen immer noch krank machen kann. Bei der synthetischen Version, haben wir diejenigen Teile entfernt, die es unserer Meinung nach pathogen machen. Also gehen wir davon aus, dass es sicher ist. Aber wir haben es noch nicht in Ziegen getestet.
Dürften Sie das denn überhaupt?
Smith: Das ist eine gute Frage. Wir habe es noch nicht getan. Es gibt andere Modellsysteme. Das Beste ware wirklich das Ziegenmodell in einer isolierten Laborsituation. Aber Ziegen sind teuer und wie viele müsste man testen?
In die synthetische Mycoplasma mycoides DNA hatten sie als eine Art Wasserzeichen auch drei codierte Sätze eingefügt.
Smith: Innerhalb von nur zwei Stunden nachdem wir die Sequenz veröffentlicht hatte, bekamen wir eine Email von jemandem, der unseren Code entziffert hatte. Michael Montgue hatte bei uns die ‘Wasserzeichen’ eingefügt, darunter auch die Email Adresse. Die Entzifferungsemail des Codes ging also direct an ihn. Es gibt einige Leute, die den Code geknackt haben. Aber wir haben es bislang nicht veröffentlicht.
Die Textzeilen, die als ‚Wasserzeichen‘ in die DNA geschrieben waren:
‚To live, to err, to fall, to triumph, to recreate life out of life’ – James Joyce
‚See things not as they are, but as they might be’ from the book, ‚American Prometheus’ – a biography of Robert Oppenheimer
‚What I cannot build, I cannot understand“ – Richard Feynman
(1) Gibson DG, Glass JI, Lartigue C, Noskov VN, Chuang RY, Algire MA, Benders GA, Montague MG, Ma L, Moodie MM, Merryman C, Vashee S, Krishnakumar R, Assad-Garcia N, Andrews-Pfannkoch C, Denisova EA, Young L, Qi ZQ, Segall-Shapiro TH, Calvey CH, Parmar PP, Hutchison CA 3rd, Smith HO, Venter JC. Creation of a bacterial cell controlled by a chemically synthesized genome. Science. 2010 Jul 2;329(5987):52-6.