Published 30 June 2011 by Tobias Maier
Neue Antibiotika durch Strukturbiologie – Tom Steitz und Ada Yonath
Ein Leitmotiv des diesjährigen Treffens ist die Frage, wie die Medizin der Zukunft aussehen könnte. Harald zur Hausen hat betont, dass möglicherweise in der Prävention von Krankheiten größeres Potential steckt als in der Entwicklung von Therapien. Martin Evans, der den Nobelpreis für Isolierung embryonaler Stammzellen erhielt, sprach die Möglichkeiten und Hürden der personalisierten Medizin an. Eine konkretere Antwort lieferte Tom Steitz. Er erklärte in seinem Vortrag, wie in seiner Arbeitsgruppe strukturbiologisches Forschungsergebnisse genutzt werden um neue Antibiotika zu entwickeln.
Steitz erhielt den Nobelpreis für Chemie 2009 zusammen mit Venki Ramakrishnan und Ada Yonath (die am Montag hier in Lindau einen Vortag hielt) für die Aufklärung der Sturkur und des Mechanismus des Ribosoms.
Ribosomenen sind große molekulare Maschinen aus zwei Untereinheiten, die jeweils aus RNA und Proteinen bestehen, und die sich nach Bindung der mRNA, also der zu übersetenden Information, zum fertigen Ribosom zusammenlagern. In einem komplizierten und trotzdem rasend schnell ablaufenden Prozess wird die mRNA durch das Ribosom geleitet, spezifische tRNAs erkennen komplementäre Sequenzen auf der mRNA und liefern die passenden Aminosäuren an, die dann am Ribosom zu Aminosäureketten verbunden werden. Die so synthetisierte Aminonsäurekette verlässt das Ribosom durch einen Tunnel in der Struktur des Ribosoms und lagert sich danach zu fertigen, funktionalen Proteinen zusammen. Ribosomen übersetzen also die genetische Information in Proteine.
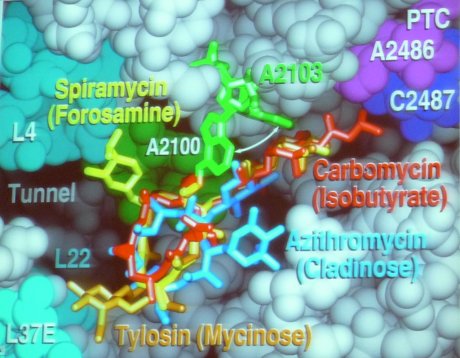
Diese komplexen Maschinen kommen in allen lebenden Organismen vor – mit kleinen, jedoch sehr wichtigen Unterschieden zwischen den bakteriellen Ribosomen und jenen in menschlichen Zellen. Diese kleinen Unterschiede bieten die Angriffspunkte für rund 40% der gängigen Antibiotikaklassen: Chloramphenicol und Tetracyclin binden beispielsweise an der Stelle an der die tRNA an das Ribosom herangeführt wird und hemmen so die Proteinsynthese. Clindamycin verhindert die Bildung der Peptidbindungen zwischen den einzelnen Aminoäuren und Erythromycin blockiert den Ausgangstunnel, es kommt sozusagen zu molekularer Verstopfung.
Blick in den Ribosomentunnel. Einige dort bindende Antibiotika sind farbig eingezeichnet
Antibiotika können therapeutisch eingesetzt werden, da sie aufgrund der kleinen Unterschiede zwischen bakteriellen Ribosomen und denen von Menschen, spezifisch die Proteinsynthese in den Krankheitserregern hemmen, die Funktion der Ribosomen in den körpereigenen Zellen jedoch nicht beeinflussen.
Gleichzeitig bergen die kleine Unterschiede zwischen den Ribosomen von Bakterien und Menschen jedoch auch die Gefahr für bakterielle Antibiotikaresistenzen. Beispielsweise reicht eine einzelne mutierte Aminosäure im Ausgangstunnel des Ribosoms aus, um die Bindung von Erythromyzin zu verhindern. Und genau hier ist der Punkt an dem biomedizinische Grundlagenforschung bei der Entwicklung neuer Antibiotika hilft.
Durch die Aufklärung der Struktur des Ribosoms durch Yonath und Steitz, buchstäblich bis aufs Atom, kann die Bindung der Antibiotika genau modelliert werden. Dadurch ist die Möglichkeit gegeben, bekannte Antibiotika zuerst am Computer so zu verändern, dass sie an neue, kritische Stellen spezifisch im Bakterienribosom binden, oder sogar ganz neue Antibiotika in silico zu entwerfen – basierend alleine auf der Kenntnis der Wechselwirkungen zwischen Aminosäureseitenketten des Ribosoms und den Bausteinen des Antibiotikums.
Es ist ein ständiger Wettlauf zwischen der Entwicklung neuer Antibiotika und der Ausbildung von Resistenzen in den Organismen, die damit abgetötet werden sollen. Durch die Ausnutzung der strukturbiologischen Kenntnis des Ribosoms hat möglicherweise wieder der Mensch die Nase vorne. Zumindest so lange, bis pathogene Bakterien sich wieder angepasst haben.
Hier eingebunden noch ein Video vom Prozess der Proteinsynthese. Es veranschaulicht die Komplexität und die Schönheit eines der grundsätzlichsten Mechanismen des Lebens. Das Video stammt von Venki Ramakrishnan, dem dritten Nobelpreisträger für das Ribosom 2009.